Atelektasen sind Feinde in der Anästhesie. Sehr böse. Nur Probleme. Oder nicht?
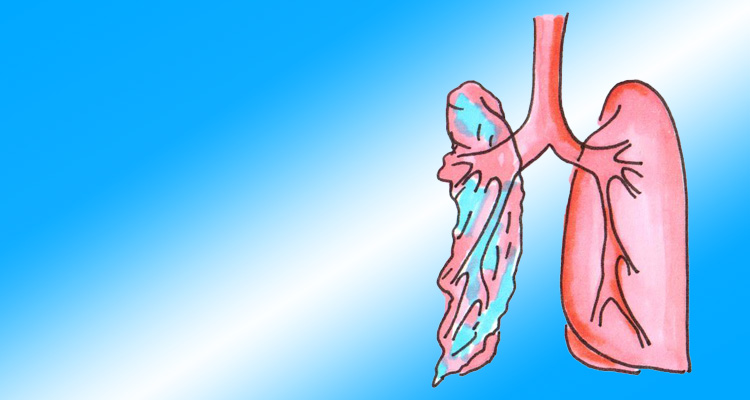
Es sind nicht belüftete Areale in der Lunge, das heißt: „zusammengefallenes Lungengewebe“ bzw. kollabierte Alveolen. Es können nur kleine Bereiche kollabiert sein, oder sogar eine gesamte Lunge (Totalatelektase).
Die Lunge wird grundsätzlich immer mehr oder weniger perfundiert. Wenn aber perfundierte Bereiche nicht ventiliert werden, kann das dort vorbei strömende Blut nicht mit Sauerstoff angereichert werden (das passiert in atelektatischen Bereichen). Es entsteht ein Ventilations-Perfusions-Mismatch und eine Vergrößerung des Rechts-Links-Shunts. Eine verschlechterte Oxygenierung des daran hängenden Körpers resultiert.
Die Ursachen können vielfältig sein:
- Verlust von Surfactant, das die Oberflächenspannung normalerweise herabsetzt und so einen Kollaps der Alveolen verhindert (zum Beispiel im ARDS oder bei hohen Sauerstoffpartialdrücken der Fall)
- direkte Kompression von Lungengewebe, zum Beispiel durch Tumore oder Ergüsse
- Obstruktion von Lungenbereichen, zum Beispiel durch Sekrektverlegung oder Fremdkörper
- Resorptionsatelektasen durch zu hohe inspiratorische Sauerstoffgaben
Atelektasenbildung ist in Narkose normal
Wie Hedenstierna et al. in einer aktuellen Studie darstellen konnte, entstehen sie bei bis zu 90% der Patienten[1]. Inspiratorische Sauerstoffkonzentrationen von 1,0 sind ein Risikofaktor. Außerdem nehmen sie zu bis zu einem Alter von 50 Jahren zu und danach wieder ab.
Die Korrelation mit dem BMI ist auch eher lose. Bis zu einem BMI von 30kg/m² korreliert die Atelektasenhäufigkeit gut, danach gibt es aber keinen Zusammenhang mehr. Die Vorstellung, dass adipöse Patienten eher von Atelektasen betroffen sind, trifft so also eher nicht zu. Interessant. Für die Gedanken zur Pathophysiologie dieser Ergebnisse verweise ich auf die verlinkte Publikation.
Atelektasenbildung ist aber nicht zwangsläufig mit einer Hypoxie intra- oder postoperativ vergesellschaftet[2]. So gesehen ist das Ergebnis der Studie zwar interessant, und man muss sich dessen bewusst sein; die Relevanz bleibt jedoch unklar.
Resorptionsatelektasen sind böse?
Wenn sie nicht gerade durch Kompression von extern entstehen, ist Resorption pathophysiologisch der wichtigste Faktor. Auch in der Obstruktion eines Lungenabschnitts wird nämlich das eingeschlossene Gas nach und nach resorbiert und die Alveolen kollabieren.
Unter „Resorptionsatelektase“ wird modern aber eine Atelektase nach Beatmung mit exzessiv hoher Sauerstofffraktion verstanden. Normalerweise dient Stickstoff N2 als Stütze der Alveolen. Er wird nicht resorbiert oder ausgeschieden, er ist einfach da. In der Umgebungsluft zu 78%, in den Alveolen ggf. etwas verdünnt, aber immer noch mit erheblichem Anteil.
Wenn wir nun in Narkose und Beatmung durch hohe Sauerstoffanteile den Stickstoff auswaschen (auf schlau: Denitrogenisieren), und durch Sauerstoff ersetzen, generieren wir ein Problem. Der Sauerstoff wird sehr schnell resorbiert, und in der Alveole bleibt wenig Restgas über (vielleicht ein bisschen einsames O2 und CO2). Da muss die Alveole ja kollabieren, da hilft auch kein Surfactant.
Die FiO2 ist so niedrig wir möglich zu wählen
Damit kommen wir zu einer alten Weisheit in der Anästhesie: Hohe Sauerstoffkonzentrationen sind böse. Denn zwar entstehen Atelektasen immer mehr oder weniger; aber durch unser Dazutun (falsche Beatmung) können wir das Ergebnis verschlechtern.
Dass wir so wenig Sauerstoff wie möglich verabreichen wollen, hat nicht nur den Grund Atelektasen zu vermindern. Wir wollen natürlich außerdem den fibrotischen Umbau der Lunge verhindern. Das geschieht ab Konzentrationen über 50% (über längere Beatmungszeiträume, nicht in der Narkose im OP).
Diagnostik
Im OP wird man Atelektasen in der Regel nicht einfach diagnostizieren können. Es gibt Spezis, die das mit Ultraschall machen. Lungenultraschall ist toll; aber noch relativ schlecht etabliert in der Breite. Bei kleinen Atelektasen wird man klinisch überhaupt nichts feststellen können; und die meisten Patienten zeigen nachher ja auch, wie oben gezeigt, überhaupt keine Symptome.
Erst bei größeren Atelektasen kommt es vor allem zu SpO2-Abfällen. In der Auskultation hört man auf der betroffenen Seite eventuell ein abgeschwächtes Atemgeräusch (DD: Pneumothorax, Tubustiefe etc.).
Auf der Intensivstation wird man in der Regel einen Röntgen-Thorax durchführen und die kollabierten Anteile darstellen können.
Therapie
Aber was machen wir denn jetzt therapeutisch gegen Atelektasen, wenn es schon soweit gekommen ist?
- Zunächst einmal sollte man natürlich die Beatmungseinstellungen und die Tubustiefe prüfen und gegebenenfalls korrigieren.
- Rekrutierungsmanöver (Lachmann-Manöver). Hierfür sind unterschiedliche Standards zu finden. Man sollte mindestens 20-30mbar für mindestens 30 Sekunden applizieren. Danach mit höherem PEEP weiter beatmen. Bei Erfolg steigt die Sättigung noch während des Manövers an. CAVE: Durch die intrathorakale Druckerhöhung kommt es zu einer Abnahme des Preload und damit gegebenenfalls zu hämodynamischer Instabilität!
- Bronchialtoilette mit Bronchoskop (Sekret-, Fremdkörperentfernung)
Zusammenfassung
Atelektasen bilden sich fast regelhaft bei beatmeteten Patienten aus. Sie sind aber nicht zwangsläufig mit einer Oxygenierungsstörung vergesellschaftet. Diagnostisch sind Lungenultraschall, der Röntgen-Thorax und ein erfolgreiches Rekrutierungsmanöver. Die Therapie richtet sich nach der Ursache: Rekrutieren und PEEP erhöhen, oder Obstruktion (Schleim, Fremdkörper) entfernen.
Bei der 08/15 Narkose im OP bei durchschnittlich gesunden Menschen habe ich bisher in meinem Anästhesisten-Leben noch keine Probleme mit Resorptionsatelektasen gehabt. Manche Kollegen haben aber eine schreckliche Angst davor.
Wie sind eure Erfahrungen?
Links:
- [1]Higher age and obesity limit atelectasis formation during anaesthesia: an analysis of computed tomography data in 243 subjects. Hedenstierna G et al., Br J Anaesth. 2020 Mar;124(3):336-344
- [2]Atelectasis during general anaesthesia for surgery: should we treat atelectasis or the patient? Gama de Abreu et al., Br J Anaesth. 2020 Mar
Begeisterter Anästhesist mit Faible für Teaching und Medizininformatik.






1 Kommentar
Hi
Ich bin ein alter Intensivmediziner und Anästhesist (ich habe deutlich mehr Intensivmedizin als Anästhesie gemacht). Auf der Intensivstation habe ich mich besonders für die Beatmung interessiert und damit beschäftigt.
Ich würde Deinem/Ihrem Vortrag folgen. Eine Kritik habe ich aber. Ich höre meine Kollegen reden, die stets sagen ich wäre ein „Spinner“ mit meinem PEEP, mit meinen 30 – 35 % O2, mit meinen ca 6 ml AZV/kgKG Normalgewicht, meinen <= 0,3 l flow usw. "Das bringt doch nichts bei 90 % unserer Patienten". Wie die Studie sagt: "Keine messbaren Auswirkungen".
In Deutschland hat JEDER Patient ANSPRUCH auf Facharztstandard, d. h. bei JEDER Narkose gibt es einen bezahlten Anästhesisten. Ich/Wir werden dafür bezahlt, dass wir Narkose machen und nicht schlafen oder kaffeetrinken. Deshalb mache ich bei JEDEM Patienten so Narkose als wenn es ein Intensivpatient wäre, weil ich vorher nicht weiss, ob mein jetziger Patient eine Komplikation erleidet und postoperativ auf der ITS behandelt werden muss. Jede Reserve kann später auf der ITS entscheidend sein.
Eigentlich habe ich nichts besseres zu tun!? Für das "der Spiegel“ lesen, E-Mails checken und oder Internetsurfen werden wir nicht bezahlt.
Ich wollte jetzt nicht suggerieren, dass Du/Sie das anders siehst. Aber es war mir ein Bedürfnis dies anzumerken!
Gruß