In diesem Artikel stütze ich mich vor allem auf das hervorragende Review von Semple et al. von 2019[1].
Transfusion-associated Circulatory Overload TACO und Transfusion-associated Acute Lung Injury TRALI sind zwei klinisch sehr ähnlich aussehende Entitäten, die innerhalb von 6 Stunden nach stattgefundener Transfusion auftreten. Beide Entitäten sind führende Ursachen für fatale Komplikationen einer Transfusion, während eine ursächliche Therapie aktuell nicht verfügbar ist.
TACO ist tatsächlich die häufigste pulmonale Komplikation einer Transfusion und ein unabhängiger Risikofaktor für Krankenhaus-Morbidität und Mortalität[2]. Die amerikanische FDA berichtete gar, dass 30% der Transfusions-assoziierten Todesfälle auf TACO zurückzuführen seien [3]
Schwierigkeitsgrad der Diagnosestellung: Dr. House Niveau
Die Diagnose ist in der Praxis aber tatsächlich sehr schwer zu stellen. Zum einen ähneln sich die beiden Entitäten sehr, und zum anderen haben Patienten mit Transfusionsbedarf (zumeist dann auch noch auf der Intensivstation) auch noch andere gute Gründe ein ARDS zu entwickeln – zum Beispiel einen hämorrhagischen Schock. (ALI ist ja eigentlich eine alte Unter-Definition des ARDS).
Das TACO (oder der 😉 ?) ist charakterisiert durch ein hydrostatisches Lungenödem – eben vor allem eine Volumenüberladung, die das Herz nicht ordentlich gepumpt bekommt. Pro Erythrozytenkonzentrat verabreicht man dem Patienten etwa 200-280ml Volumen. Bei entsprechend vielen EKs führt das zwangsläufig zu einer Überladung des Patienten, wenn die wässrigen Anteile unten nicht schnell genug wieder raus kommen.
Das TRALI ist ein nicht-kardiogenes Lungenödem, ausgelöst durch Antileukozyten-Antikörper des Spenderbluts, die eine polymorphnukleäre Leukozyten-Degranulation in der Lunge auslösen.
Two-Hit-Modell als Ursachenbeschreibung
Die Pathophysiologie ist aber nicht endgültig verstanden. Landläufig wird von einem Two-Hit-Modell ausgegangen. Der erste Hit ist die eine zugrunde liegende Erkrankung des Patienten, der zweite Hit dann die Transfusion des Blutprodukts.
Beim TACO scheinen Vorerkrankungen der Nieren, des Herzens (Herzinsuffizienz, Kardiomegalie, akutes Nierenversagen) und eine generell positive Bilanzierung eine Entstehung zu begünstigen. Neben der reinen Volumenüberlast durch das verabreichte Blutprodukt scheinen aber weitere nicht endgültig verstandene Prozesse beteiligt zu sein.
Das TRALI wurde zuerst beschrieben von Barnard 1951, der von einem Patienten mit akuter Leukämie berichtete, der nach Transfusion an einer pulmonalen Reaktion verstarb. Der erste Hit ist hier chronischer Alkoholabusus, Leberchirurgie, hoher Beatmungsspitzendruck[5], oder systemische Inflammation[6]. Der zweite Hit sind die bereits genannten Anti-HLA-I und -II Antikörper, sowie Anti-HNA-Antikörper, jedoch nur in bis zu 80% der Fälle nachweisbar[7]; in den restlichen 20% der Fälle werden nicht-Antikörper gebundene Mediatoren vermutet, wie Lipid-Mediatoren, extrazelluläre Vesikel oder gealterte Blutzellen: Non-antibody-mediated TRALI[8].
Eine Schlüsselrolle in der Entstehung scheinen PMNs, das sind polymorphnukleäre Granulozyten, zu spielen. Protektive Zellen scheinen CD4+CD25+FoxP3+ T-regulatorische Zellen und dendritische Zellen zu sein.
Die beschriebene Inzidenz variiert nach zitierter Quelle zwischen 0,08-15,1% pro Patient oder 0,01-1,12% pro Blutprodukt[4]. Bei der FDA führt es die Liste der Ursachen für tödliche Transfusionszwischenfälle mit 34% an.
Klinik und Diagnostik
Die Klinik ähnelt sich stark und ist durch akute Atemnot innerhalb von 6 Stunden nach Transfusion eines Blutprodukts geprägt. Diffuse Infiltrate als Zeichen eines Lungenödems werden im Röntgen sichtbar.
Diagnostische Kriterien wurden von verschiedenen Organisationen vorgeschlagen. Für das TACO von der National Healthcare Safety Network 2016 oder der International Society of Blood Transfusion 2011; für das TRALI die 2005 Definition der National Heart, Lung, and Blood Institute Working Group oder die 2004er Definiton der Canadian Consensus Conference criteria.
Abkürzend kann man sagen, dass das TACO kardiogen bedingt ist: Positive Volumenbilanz, Linksherzversagen, Hypertonie, Tachykardie. TRALI hingegen ist strikt nicht-kardiogen! Das bedeutet für die Praxis, dass eine Volumenüberlast bei vermutetem TACO/TRALI diagnostisch sein kann und deshalb untersucht werden muss. Außerdem darf es für die Diagnose des TRALI keine weiteren Risikofaktoren geben wie Sepsis, Pneumonie, Pankreatitis etc.; sobald das nämlich der Fall ist, kann man nur noch von einem „V.a. TRALI“ sprechen.
Die Therapie bleibt supportiv
Trotz der vielen Ideen, Tiermodelle und Untersuchungen (mit denen arme Anästhesisten verwirrt werden sollen), steht keine kausale Therapie für beide Entitäten zur Verfügung. Es bleibt nur die supportive Therapie von Atmung und Kreislauf. Das sollte man als Anästhesist ja hinbekommen. Immerhin. Dennoch sind die Krankheitsbilder mit einer signifikanten Mortalität vergesellschaftet.
Präventive Strategien beginnen bei der Auswahl vor allem der Plasmaspender: Akzeptieren nur von männlichen Plasmaspendern (scheinbar erhöhte TRALI Inzidenz bei weiblichem Blutplasma!), Ablehnung von Spendern nach Antikörper-Screening, von Spendern selbst erhaltenen Transfusionen oder Schwangerschaft. Diese Maßnahmen scheinen die TRALI-Inzidenz deutlich zu senken[9] – aber andere Studien widersprechen dem. Na super.
Die Suche nach potentiellen Therapien für TRALI geht weiter. Möglichkeiten scheinen zu sein: IL-10 Therapie, Downregulation der CRP-Spiegel, Reaktive Sauerstoffspezies, oder die Blockade von IL-8-Rezeptoren.
Für TACO gibt es indes keine Idee eines kausalen Therapieansatzes. Weitere Tiermodelle müssen entwickelt werden, da nicht nur die reine Volumenüberlast auslösend zu sein scheint. Es bleibt spannend.
Wer seinen inneren Hämatologen nicht bändigen kann, der darf gerne im verlinkten Review in die Welt der Zytokine, Mediatoren und Zelllinien herabsteigen. Ich wünsche viel Vergnügen dabei!
Links:
- [1]Semple et al.,Transfusion-associated circulatory overload and transfusion-related acute lung injury, Blood 2018
- [2]Semple JW, Rebetz J, Kapur R. Transfusion-associated circulatory overload (TACO): Time to shed light on the pathophysiology. ISBT Sci Ser. 2018;ISBT Sci Ser. 2019;14(1):136-139
- [3]FDA, Transfusion Donation Fatalities
- [4]Vlaar AP, Juffermans NP. Transfusion-related acute lung injury: a clinical review. Lancet. 2013;382(9896):984-994.
- [5]Toy P, Gajic O, Bacchetti P, et al; TRALI Study Group. Transfusion-related acute lung injury: incidence and risk factors. Blood. 2012;119(7):1757-1767
- [6]Semple JW, McVey MJ, Kim M, Rebetz J, Kuebler WM, Kapur R. Targeting transfusion-related acute lung injury: the journey from basic science to novel therapies. Crit Care Med. 2018;46(5):e452-e458.
- [7]Peters AL, Van Stein D, Vlaar AP. Antibody-mediated transfusion-related acute lung injury; from discovery to prevention. Br J Haematol. 2015;170(5):597-614.
- [8]Peters AL, van Hezel ME, Juffermans NP, Vlaar AP. Pathogenesis of non-antibody mediated transfusion-related acute lung injury from bench to bedside. Blood Rev. 2015;29(1):51-61.
- [9]Müller MC, van Stein D, Binnekade JM, van Rhenen DJ, Vlaar AP. Low-risk transfusion-related acute lung injury donor strategies and the impact on the onset of transfusion-related acute lung injury: a meta-analysis. Transfusion. 2015;55(1):164-175
Begeisterter Anästhesist mit Faible für Teaching und Medizininformatik.

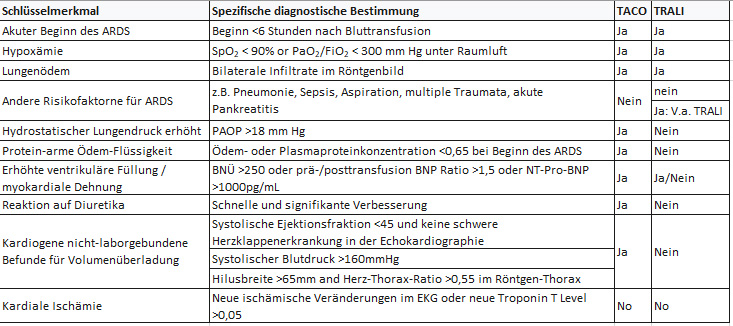 nach Semple et al. 2019 [1]
nach Semple et al. 2019 [1]



